蛋白糖基化修饰
产品介绍:
蛋白质糖基化修饰(Glycosylation)是指蛋白质在酶的作用下被连接上糖链的过程。细胞内超过 50% 的蛋白质都修饰有糖链。连接于天冬酰胺(Asn)残基上的N-糖基化在真核生物中广为存在,也是研究最为深入的一种糖基化形式。蛋白质N-糖基化修饰主要在复杂的多细胞或组织形成过程中起关键作用,参与细胞识别、免疫应答、细胞分化等生命活动。 蛋白质经酶解后利用凝集素(lectin)富集N-糖基化肽段,再用N-糖酰胺酶(PNGase)在重水中切除糖链,然后通过LC-MS/MS对糖基化位点进行分析,实现大规模N-糖基化蛋白质定性定量分析。
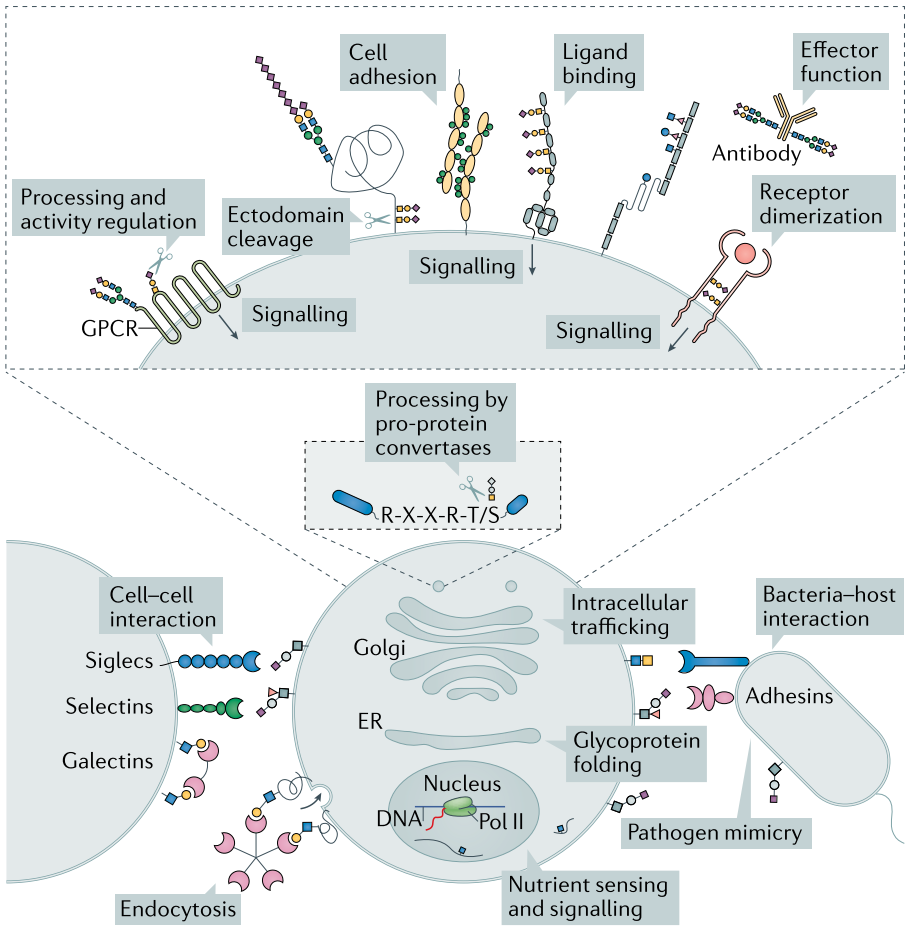
蛋白质糖基化过程及功能
技术优势:
(1) 高特异性的修饰抗体
(2) 高分辨率、高灵敏度质谱仪
(3) 鉴定通量高
(4) 可与代谢组学等进行多组学联合分析
应用方向:
♦ 医学研究
疾病机理机制研究、诊断分子标志物、药物靶点
♦ 动物研究
动物生殖发育机制、动物疾病机理、动物营养代谢与调控、动物毒理研究
♦ 植物研究
植物生殖发育机制、非生物胁迫应答机理、植物抗病机理、作物改良
♦ 微生物
致病机制及耐药性研究、胁迫相关蛋白筛查及机制研究、环境作用机理
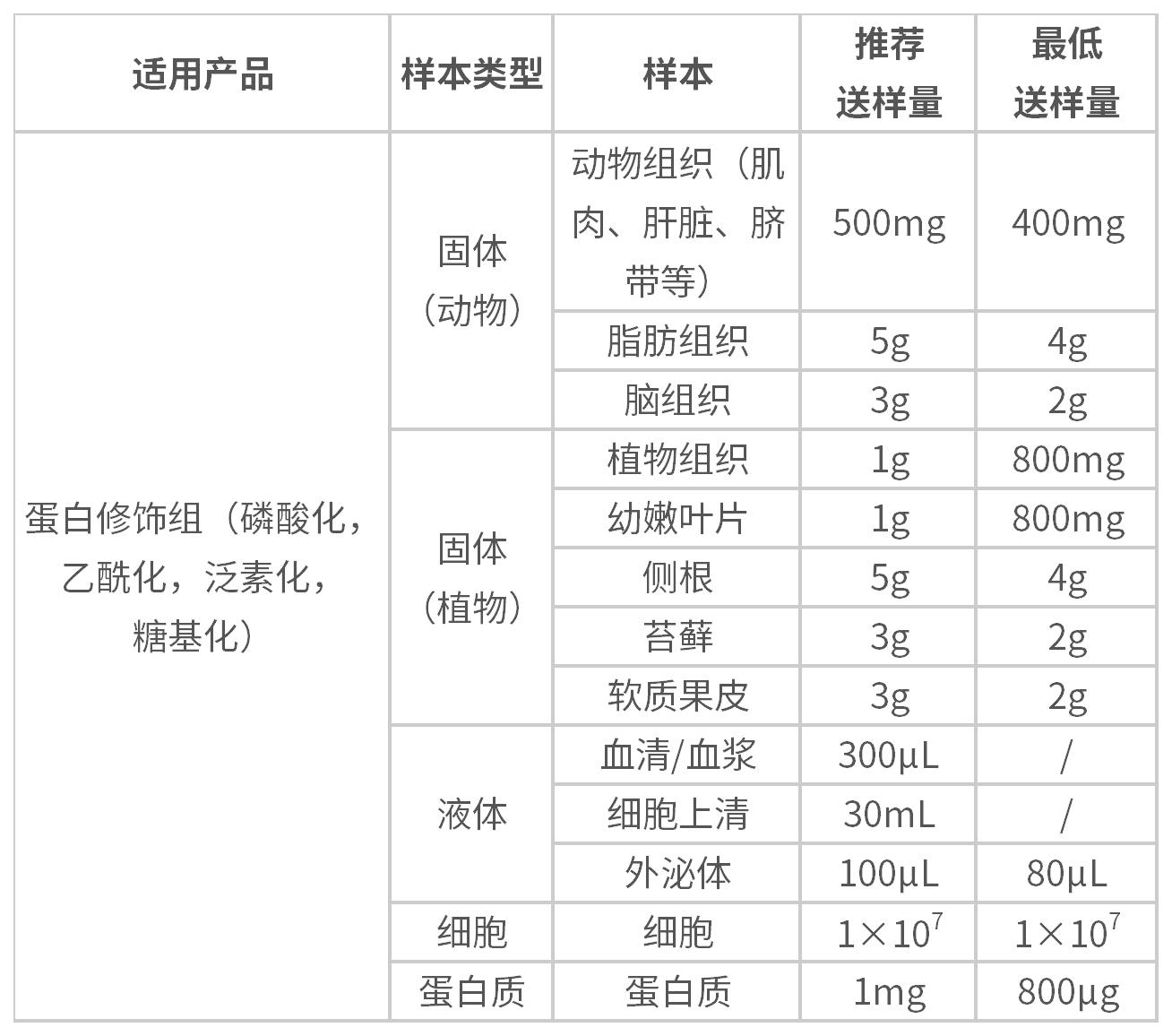
样本要求:
研究思路:
Integrated Proteomic and Glycoproteomic Characterization of Human High-Grade Serous Ovarian Carcinoma
人类高级别浆液性卵巢癌的综合蛋白质组学和糖蛋白组学特征
期刊:Cell Report,发表时间:2020.10,影响因子:9.423
研究背景:
由于一系列修饰,许多基因产物表现出很大的结构异质性。这些修饰不是直接编码在基因组模板中,而是经常影响蛋白质的功能。蛋白质糖基化在适当的蛋白质功能中起着至关重要的作用。然而,与磷酸化等其他蛋白质修饰相比,糖蛋白的分析一直具有挑战性。本文对83个前瞻性收集的高级别浆液性卵巢癌 (HGSC)和23个非肿瘤组织进行了综合蛋白质组学和糖蛋白组学分析。来自蛋白质组学和糖蛋白组学的表达数据的整合揭示了肿瘤特异性糖基化,并确定了与改变的糖基化相关的糖基化酶。除了提供有价值的资源外,这些结果还提供了对糖基化在HGSC发病机制中的潜在作用的见解,并有可能区分卵巢肿瘤与非肿瘤的病理结果,以及对肿瘤簇进行分类。
研究思路:
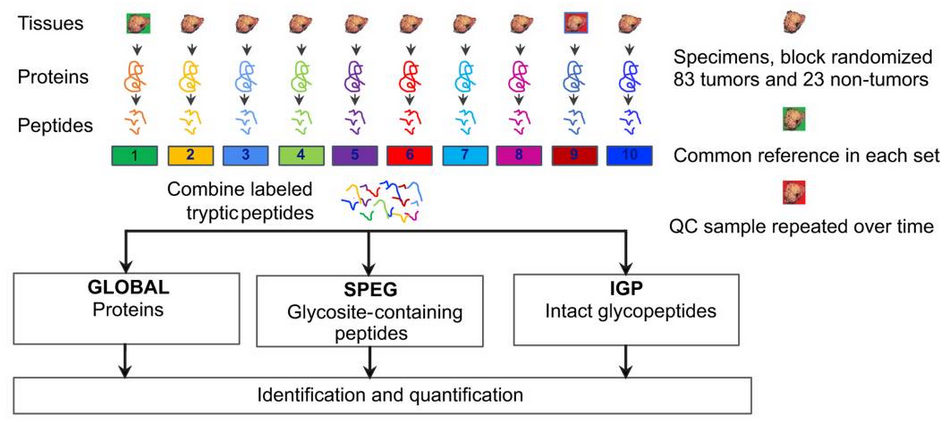
研究结果:
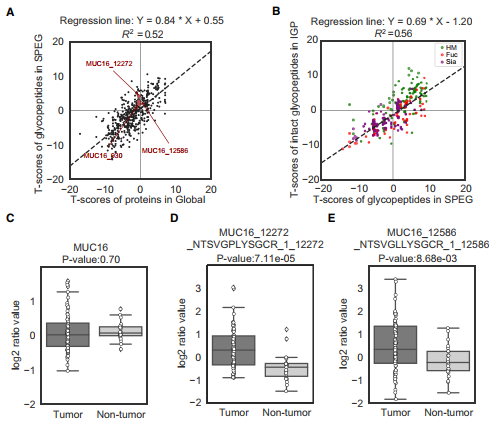
糖蛋白在HGSC及健康输卵管组织中的表达差异
研究结论:
在这项研究中,综合多组学分析,包括HGSC的蛋白质组学和糖蛋白质组学分析,证明了糖基化与卵巢癌的联系。通过应用肿瘤和非肿瘤之间多组学数据的差异表达,确定了几种潜在的肿瘤特异性蛋白、糖蛋白和聚糖。进一步的研究表明,肿瘤中糖蛋白的差异表达可以表现为糖位点的糖基化程度不同,以及糖位点上聚糖的类型。肿瘤的糖基化生物合成途径与非肿瘤的不同。由于PRKCSH的上调和MAN1A1的下调,与非肿瘤相比,N-连接的糖蛋白在肿瘤中可以携带更多的HM聚糖,但在肿瘤中可以携带更少的杂化或不太复杂的聚糖。这可能是PRKCSH在肿瘤中调节糖蛋白有效产生、抵抗环境压力和溶酶体过度活化的常见机制。最后,对HGSC肿瘤样本进行全面的蛋白质组学和糖蛋白组学测量提供了宝贵的公共资源。将糖蛋白与其糖基化程度、聚糖修饰和糖基化酶联系起来的糖蛋白组学数据将提高对卵巢癌分子基础的理解。
推荐文章

武汉迈维代谢生物科技股份有限公司
科服医学热线:027-62433042
科服农学热线:027-62433072
临床检测热线:400-9616-061
科服咨询邮箱:support@metware.cn
临检咨询邮箱:medsupport@metware.cn







